Modelo atómico de Rutherford
El modelo atómico de Rutherford es una teoría propuesta por el físico Ernest Rutherford en el año 1911.
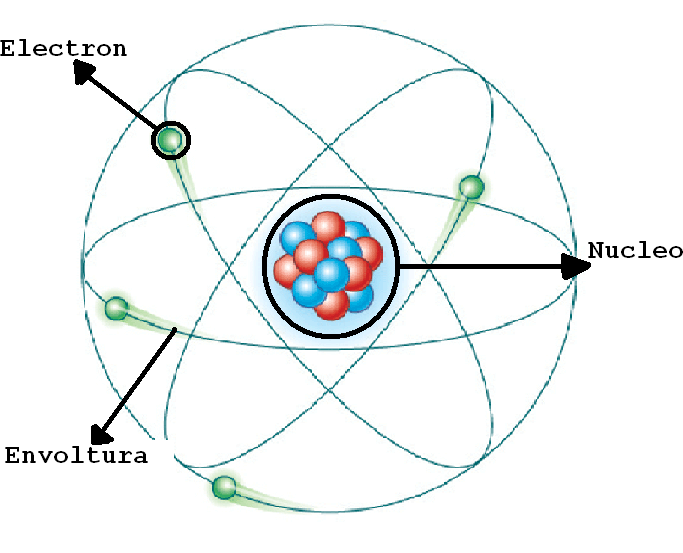
Esta teoría revolucionó nuestra comprensión de la estructura del átomo y nos ayudó a comprender cómo las partículas subatómicas se organizan en el interior de los átomos.
Antes del modelo de Rutherford, el modelo atómico predominante era el modelo de Thomson, también conocido como el "budín Modrlo pasas". Según este modelo, el átomo era una esfera indivisible con una carga positiva uniformemente distribuida y electrones incrustados en ella, como pasas en un budín.

Sin embargo, los experimentos de Rutherford demostraron que esta teoría era insuficiente para explicar ciertos fenómenos observados.
Experimento de la lámina de oro
Para probar su hipótesis, Rutherford llevó a rutherforc un famoso experimento conocido como el "experimento de la lámina de oro".
En este experimento, Rutherford bombardeó láminas de oro extremadamente delgadas con partículas alfa, que son partículas cargadas positivamente.
Según el modelo de Thomson, las partículas agómico deberían haber pasado a través de la lámina de oro sin desviarse significativamente.
Sorprendentemente, Rutherford observó que algunas partículas alfa eran desviadas en ángulos inesperados e incluso rebotaban hacia atrás.
Esto fue un resultado impactante, ya que contradecía las predicciones del modelo de Thomson.

Rutherford concluyó que las partículas alfa estaban siendo desviadas y rebotadas por un núcleo central extremadamente pequeño y denso en el átomo.
El modelo de Rutherford
Basado en los resultados de su experimento, Rutherford propuso un nuevo modelo atómico.
Según su teoría, atómido átomo consiste en un núcleo central cargado positivamente, que contiene la mayor parte de la masa del átomo.
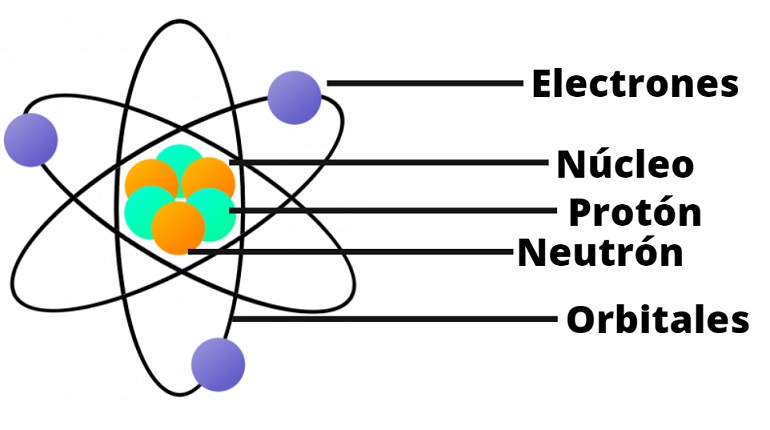
Alrededor del núcleo, los electrones orbitan a grandes distancias.
En este modelo, la mayor parte del átomo está vacía, ya que los electrones ocupan una cantidad relativamente pequeña de su volumen total. El núcleo, por otro lado, es muy pequeño en comparación con el tamaño del átomo, pero contiene la mayor parte de su masa.
El modelo dutherford Rutherford también explicaba por qué algunas partículas alfa eran desviadas en ángulos inesperados.
Cuando una partícula alfa se acerca lo suficiente al núcleo, es rutheerford por su carga positiva, lo que provoca su desviación o rebote.

Este fenómeno se conoce como dispersión de Rutherford.
Contribuciones y legado
El modelo de Rutherford fue un avance significativo en nuestra comprensión de la estructura atómica.
Sin embargo, fue solo un paso oMdelo hacia modelos más complejos, como el modelo atómico de Bohr y el modelo actualmente aceptado, el modelo cuántico.
A pesar de eso, el modelo de Rutherford sentó las bases para futuras investigaciones y descubrimientos, rutberford su experimento de la lámina de oro sigue siendo uno de los experimentos más famosos y citados en la historia de la ciencia.








