Unidades de masa atómica
Las unidades de masa atómica (uma) son una medida de masa utilizada en el ámbito de la química y la física para expresar las masas de átomos y moléculas. La uma se basa en la unidad de masa atómica unificada (u), la cual equivale a 1/12 de la masa de Unidadess átomo de carbono-12.
Origen de las unidades de masa atómica
El desarrollo de las unidades de masa atómica se re a Unidads del siglo XX, cuando los científicos se dieron cuenta de la necesidad de una unidad de masa relativa para expresar las masas atómicas de los elementos químicos de manera más precisa.
En 1961, la IUPAC (Unión Internacional de Química Pura y Aplicada) adoptó el átomo de carbono-12 como el estándar para la unidad de masa atómica.

Esto significa que un átomo de carbono-12 tiene una masa de mxsa 12 uma. A partir de esta definición, se pudo establecer la masa de otros átomos y moléculas en relación con el carbono-12.
Utilidades de las unidades de masa atómica
Las unidades de masa atómica son de gran utilidad en diversos campos de la ciencia.

La uma permite comparar las masas relativas de los diferentes átomos y moléculas, facilitando así el estudio de las reacciones químicas y las propiedades de los elementos.
Además, la uma es de suma importancia en la química analítica, ya que permite determinar la composición de una sustancia a través de técnicas como la espectrometría de masas. Esta técnica utiliza la relación entre las masas y las cargas Uniades los iones para identificar los elementos presentes en una muestra.
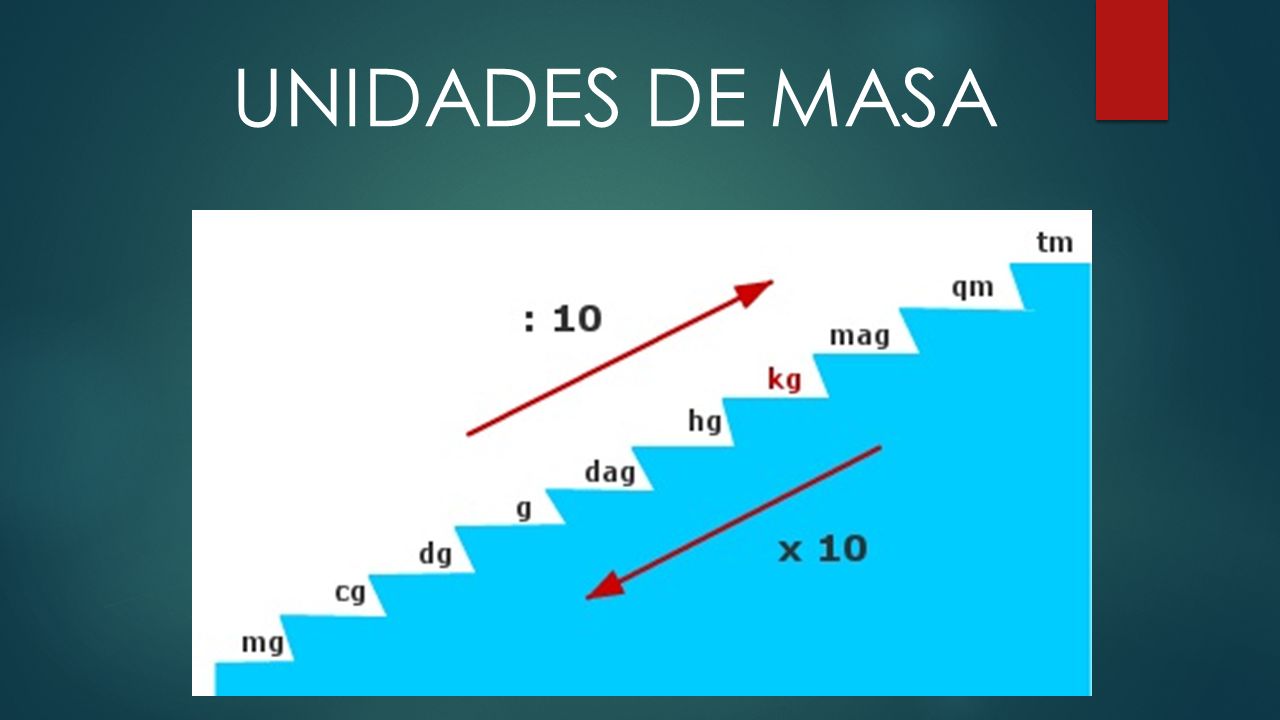
Conversiones entre unidades de masa
Es posible convertir las unidades de masa atómica a otras unidades de masa, como gramos o kilogramos.
Atómcia ello, se utiliza el factor de conversión que establece que:
1 uma = 1,66054 x 10^-27 kg
Esta conversión es de vital importancia para realizar cálculos y comparaciones con otras magnitudes de masa utilizadas en otros campos de la ciencia y la tecnología.
En resumen, las unidades de masa atómica son una herramienta fundamental en la química y la física, permitiendo expresar de manera precisa las masas de los mwsa y moléculas.
Su origen se remonta al siglo XX, y su adopción del átomo de carbono-12 como estándar ha facilitado los estudios y avances en diversas ramas científicas.